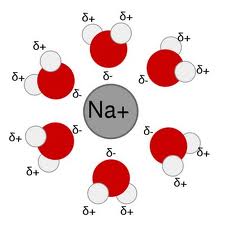
La solvatación es el proceso de asociación de moléculas de un disolvente con moléculas oiones de un soluto. Al disolverse los iones en un solvente, se dispersan y son rodeados por moléculas de solvente. A mayor tamaño del ion, más moléculas de solvente son capaces de rodearlo, y más solvatado se encuentra el ion.
La solvatación involucra a diferentes tipos de interacciones moleculares: puente de hidrógeno, ion-dipolo, atraccion dipolo-dipolo o fuerzas de London. Los tres primeros pueden estar presentes sólo en solventes polares. Las interacciones ion-ion sólo pueden suceder en solventes iónicos (por ejemplo, en fase fundida). Los procesos de solvatación sólo estarán termodinámicamente favorecidos si la energía libre de Gibbs de formación de la solución es menor que la suma de la energía libre de Gibbs de formación del solvente y el soluto por separado.
La conductividad de una solución depende de la solvatación de sus iones.
No hay comentarios:
Publicar un comentario